こんにちは。Horyです。
炭化水素の性質に関する話が終了してこの記事でもアルコールに関する解説をすることになりました。
アルコールの記事はいくつかに分けようと思いますが、この記事ではアルコールの基本的な性質と級数による性質の違いを簡単にまとめようと思います。
今回も頑張りましょう。
酸化と還元について・・・
アルコールは酸化と還元が密接に関わってきます。
酸化と還元については無機化学でも散々説明してきました。
なので、ここでは簡単に解説します。
- 酸化・・・電子を失う (有機では水素を失う)
- 還元・・・電子を与える (有機では水素を得る)
- 酸化剤・・・相手を酸化させ自分は還元 (相手の電子を奪い自分は得る)
- 還元剤・・・相手を還元させ自分は酸化 (相手に電子与えて自分は失う)
- 電子は還元剤→酸化剤で移動
どの原子が酸化、還元されるかは原子同士の電気陰性度で決まって、電気陰性度は「俺の電子は俺のもの、お前の電子は俺のもの」という気持ちの数値化です。
有機化学ではH,C,N,Oがありますが・・・
- H・・・のび太 (電気陰性度2.1)
- C・・・スネ夫 (電気陰性度2.5)
- N・・・しずかちゃん (電気陰性度2.8)
- O・・・ジャイアン (電気陰性度3.5)
ここら辺を頭に入れておいてください。
アルコールについて
アルコールと聞くとビールとかを思い浮かべると思いますが間違ってないです。
具体的には鎖式や脂環式炭化水素のHをOHにしたものをアルコールと言います。
- 脂肪族+OH・・・アルコール
- 芳香族(ベンゼン)+OH・・・フェノール
二重結合を持つアルコールも当然ありますが、高校化学で出るモノは単結合のアルコールが多く化学式はCnH2n+2Oになります(ただし、エーテルの可能性もあるのでこの式を見たら必ずアルコールと考えるのは危険です)。
- アルコールの価数
- 分子中にヒドロキシ基1つ・・・一価アルコール
- 分子中にヒドロキシ基2つ・・・二価アルコール
- 分子中にヒドロキシ基3つ・・・三価アルコール
また、アルコールの級数について、図に示すと・・・
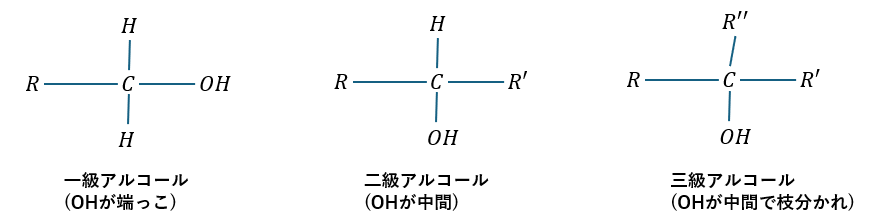
R,R’,R’’は炭化水素だと考えてください。図に示したことをもっと具体的にすると・・・
- 一級アルコール・・・OHに繋がるCが1つの炭素と結合 (図ではR)
- 二級アルコール・・・OHに繋がるCが2つの炭素と結合 (図ではR,R’)
- 三級アルコール・・・OHに繋がるCが3つの炭素と結合 (図ではR,R’,R’’)
アルコールは級数によって性質が変わってきます。
この記事で全てを説明すると大変なので、今回は融点・沸点と水への可溶性について話します。
融点・沸点
融点や沸点の違いについて解説します。
- 官能基異性体
- アルコール・・・水素結合できる
- エーテル・・・水素結合できない
- 同じ炭素数なら沸点・融点は「アルコール>エーテル」

このように同じ炭素数のアルコールとエーテルではアルコールの方が沸点・融点は高いです。
- 級数による沸点の違い
- 「一級>二級>三級」
- 理由;周りに炭素が多いほどOHの水素結合を妨げる (立体障害)
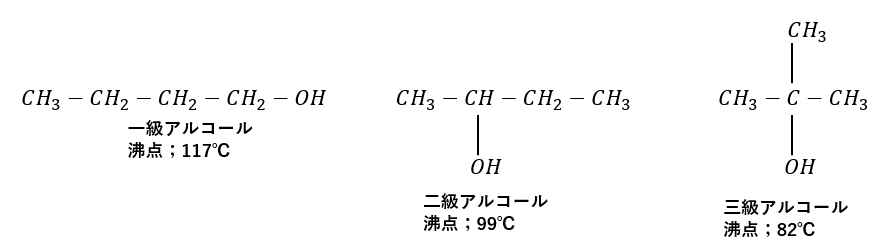
- 分子式も級数も同じ
- 「直鎖のアルコール>枝分かれありのアルコール」
- 理由;直鎖の方が分子同士の接触がしやすく分子間力が大きい
水への可溶性
アルコールが水に溶けるか溶けないかは電離するかどうかで決まってきます。
- OH部分・・・水に溶けやすい
- R(炭化水素)部・・・水に溶けにくい
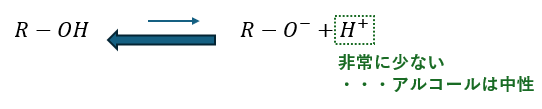
アルコールは水に溶けやすい部分と溶けにくい部分が共存している分子です。
溶けるか溶けないかはR部の炭素数に依存します。
また、アルコールは電離がしにくいので中性です。




コメント