こんにちは。Horyです。
前回はアルコールの性質と級数による性質の違いをまとめました。
今回の記事はアルコールの反応性で脱水に焦点を当てた話をします。
この中でザイツェフ則という有名な法則があって、高校化学では発展内容とされていますが、理系の化学入試問題では普通に出てくるので是非理解してほしいです。
今回も頑張りましょう。
アルコールの反応プロセス
アルコールの反応プロセスを解説します。
私たちが入試で見るアルコールは二重結合がなく、全て単結合(σ結合)でできています。
σ結合は非常に硬いので反応させるには結合をブチブチ切るような強酸とかが必要です。
「結合がブチブチ切れる」と説明しましたが、どこで、ブチブチ切れるかが大切です。
ここで、重要になるのが電気陰性度の差になります。
電気陰性度は「俺の電子は俺のもの、お前の電子は俺のもの」という気持ちの数値化です。
- 電気陰性度
- H (のび太)・・・2.1
- C (スネ夫)・・・2.5
- O (ジャイアン)・・・3.5
そして、結合において、電気陰性度の差が大きいほど切れやすいです。
- 反応性・・・「O-H > O-C > C-H」
- O-H・・・ジャイアンがのび太の電子を無理矢理奪う・・・関係切れやすい
- O-C・・・ジャイアンがスネ夫の電子を無理矢理借りた・・・関係はギスギス
- C-H・・・スネ夫がのび太から電子を借りてる・・・関係はそんなに悪くない
アルコールの反応で有名なのは金属ナトリウムの反応です。
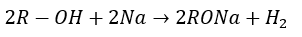
- ① アルコールにのび太よりも弱いNa(電気陰性度2.1以下)登場
- ② ジャイアンはのび太より弱いナトリウムをいじめる
- ③ ナトリウムアルコキシドが生成されのび太は代わりに解法
余談ですが、エーテルはナトリウムと反応しません(試験での手がかりになるので覚えておいてください)。
アルコールの脱水
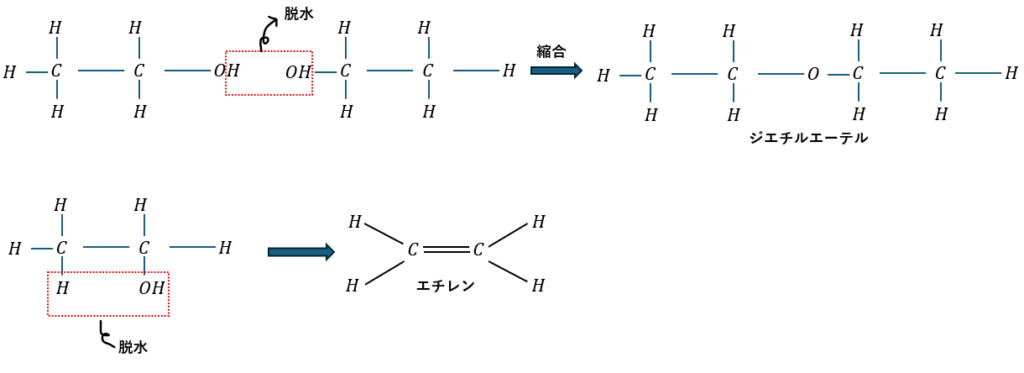
アルコールの脱水にも二通りあります。
- 穏やかに脱水・・・縮合→エーテルの生成
- 激しく脱水・・・脱離→アルケンの生成
教科書に出てくるのはエタノールの脱水です。
- エタノールの脱水
- 穏やか(130~140℃)に脱水→ジエチルエーテルの生成
- 激しく(160~170℃)脱水→エチレンの生成
分かりやすいように図に示します。
ザイツェフ則の原理
ザイツェフ則とはアルコール分子内脱水の経験則のことを言います。
具体的にはアルコールの脱水でアルケンが生成する際に「-OH結合しているC原子の両側のC原子の内、水素原子の数が少ない方から優先的に失われる」という規則です。
具体例を図に示します。
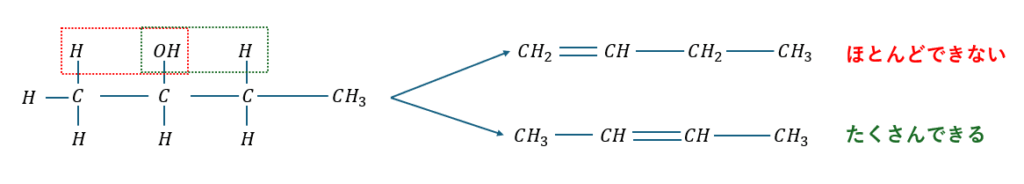
- OHの左側の炭素・・・水素原子3つ
- OHの右側の炭素・・・水素原子2つ
- のび太を多く持つスネ夫・・・傲慢でのび太を手放さない
- のび太が少ないスネ夫・・・まだのび太の気持ちが分かる→手放せる
上のように覚えてみてください。



コメント