こんにちは。Horyです。
前回の記事ではベンゼンのニトロ化とスルホン化に関して説明しました。
今回の記事ではアニリンに関して製法と性質を原理から解説しようと思います。
ちなみに、別の記事で話しますが、アニリンは表紙画像の皿に描かれている青色の染料の原料になっています(インディゴと呼ばれている)。
今回も頑張りましょう。
アニリンの製法
まぁ、いきなりアニリンと聞いても分からないと思います。
アニリンとはベンゼンにNH2が直接結合した有機化合物のことです。
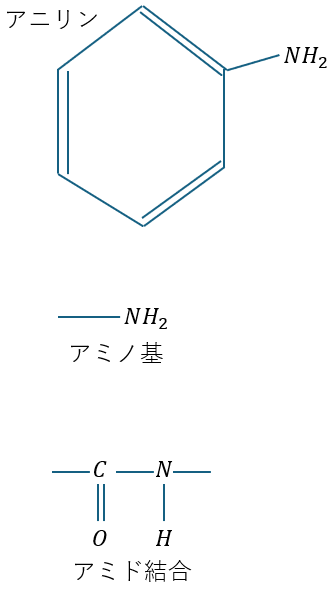
アニリンの製法は鉄を還元剤、ニトロベンゼンを酸化剤として反応させることで生成できます。
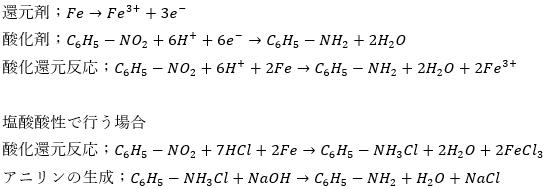
- アニリンの性質
- アニリンは弱塩基性物質
- 酸化されやすい
- 無水酢酸と反応してアミド化
上の3つの性質に関して詳細に解説しようと思います。
弱塩基性の理由
アニリンが弱塩基性の理由を解説します。
結論を言ってしまうとアニリンのNにおける非共有電子対が原因です。図を用いて説明します。
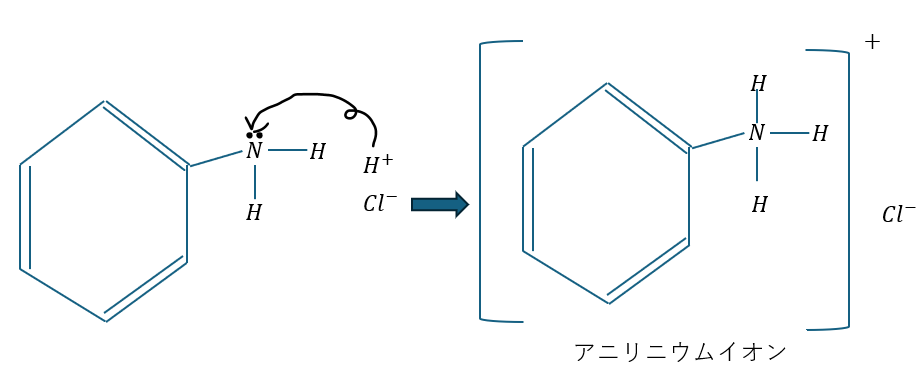
水素イオンが窒素の非共有電子対を求めてアニリンに結合しようとします。だから、塩基性物質なのです。
ただし、ベンゼンの共鳴を覚えていますでしょうか?
ベンゼンの共鳴効果で窒素の非共有電子対がベンゼンに引き込まれます。そのため、アンモニアと比較すると水素イオンが行きにくいのでアンモニアと比較すると塩基性は弱いです。
- わかりやすい例
- アニリンのN(しずかちゃん)は非共有電子対
- H(のび太)がN(しずかちゃん)を求めてアタック
- 結果的に塩基性を示す
酸化されやすい理由
酸化されやすい理由についてもアニリンの窒素の非共有電子対が原因です。
窒素の非共有電子対が酸化剤の攻撃を受けて電子を奪われるのです。
酸化と還元の定義を復習しましょう。
- 酸化・・・電子を奪われる
- 還元・・・電子を得る
- 電子の流れは酸化剤→還元剤
- さらし粉(CaCl(ClO)・H2O)との反応→赤紫色に呈色
- 二クロム酸カリウムとの反応→アニリンブラックの生成
無水酢酸との反応
無水酢酸との反応を解説します。これはアミド化と呼ばれる減少になります。
まぁ、これも上の反応と同様にアニリンの窒素の非共有電子対が鍵になります。
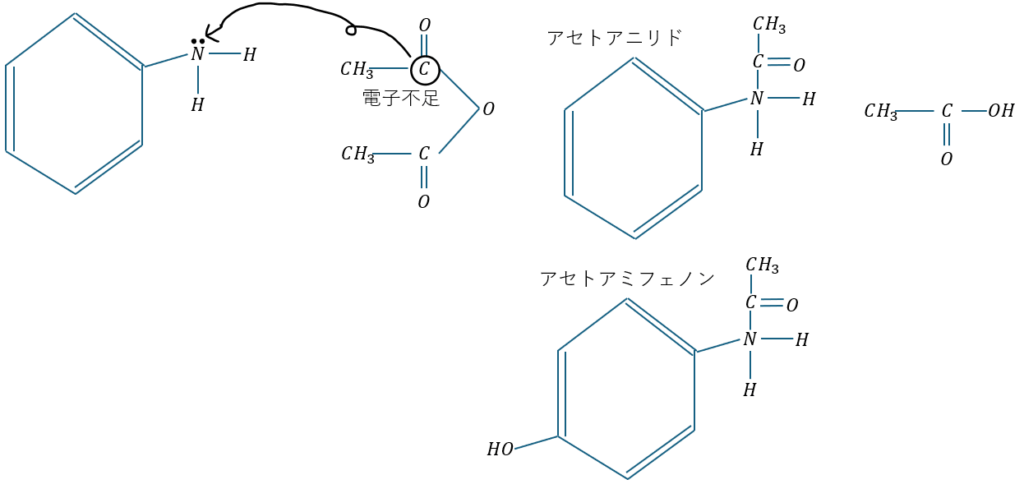
まぁ、アミド化と呼ばれていますが、アセチル化です。
アセトアニリドは解熱剤として用いられた過去もありますが、副作用(具体的には毒性が強く、血液に影響を与えやすい)が非常に強かったので現在はアセトアミフェノンが使われています。



コメント